| |
 |
| ГЛАВА 3. Второе и третье начала термодинамики |
 |
|
 |
|
| |
 |
3.9. Закон возрастания энтропии
Применим неравенство Клаузиуса для описания необратимого кругового термодинамического процесса, изображенного на рис 3.13. | Рис. 3.13.
Необратимый круговой термодинамический процесс |
Пусть процесс 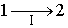 будет необратимым, а процесс 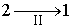 - обратимым. Тогда неравенство Клаузиуса для этого случая примет вид
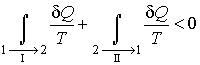 . . | (3.55) |
Так как процесс 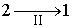 является обратимым, для него можно воспользоваться соотношением (3.53), которое дает
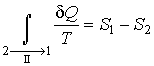 . . | (3.56) |
Подстановка этой формулы в неравенство (3.55) позволяет получить выражение
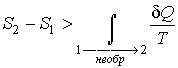 . . | (3.57) |
Сравнение выражений (3.53) и (3.57) позволяет записать следующее неравенство
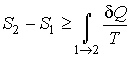 , , | (3.58) |
в котором знак равенства имеет место в случае, если процесс 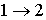 является обратимым, а знак больше, если процесс 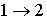 - необратимый.
Неравенство (3.58) может быть также записано и в дифференциальной форме
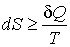 . . | (3.59) |
Если рассмотреть адиабатически изолированную термодинамическую систему, для которой 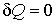 , то выражение (3.59) примет вид
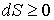 | (3.60) |
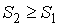 . . | (3.61) |
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Записанное утверждение является ещё одной формулировкой второго начала термодинамики.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.
Необходимо отметить, что если система не является изолированной, то в ней возможно уменьшение энтропии. Примером такой системы может служить, например, обычный холодильник, внутри которого возможно уменьшение энтропии. Но для таких открытых систем это локальное понижение энтропии всегда компенсируется возрастанием энтропии в окружающей среде, которое превосходит локальное ее уменьшение.
С законом возрастания энтропии непосредственно связан парадокс, сформулированный в 1852 году Томсоном (лордом Кельвином) и названый им гипотезой тепловой смерти Вселенной. Подробный анализ этой гипотезы был выполнен Клаузиусом, который считал правомерным распространение на всю Вселенную закона возрастания энтропии. Действительно, если рассмотреть Вселенную как адиабатически изолированную термодинамическую систему, то, учитывая ее бесконечный возраст, на основании закона возрастания энтропии можно сделать вывод о достижении ею максимума энтропии, то есть состояния термодинамического равновесия. Но в реально окружающей нас Вселенной этого не наблюдается.
Попытка избежать указанного противоречия гипотезы тепловой смерти Вселенной была предпринята Больцманом, который показал, что и в состоянии термодинамического равновесия наблюдаются флуктуации термодинамических параметров. Если считать, что наблюдаемая Вселенная является следствием такой флуктуации, то противоречия парадокса тепловой смерти Вселенной снимаются. Более подробно равновесные флуктуации описаны в пятой главе.
Задача 3.7. Термодинамическая система, состоящая из двух находящихся в тепловом контакте тел, помещена в адиабатическую оболочку. Теплоемкости тел одинаковы и равны 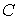 . Температура первого тела в некоторый момент времени равна . Температура первого тела в некоторый момент времени равна 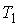 , а второго - , а второго - 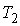 , причем , причем 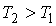 . Найти уравнение, описывающее изменение энтропии системы с течением времени при её стремлении к состоянию термодинамического равновесия. Считать, что передача теплоты от одного тега к другому описывается формулой: . Найти уравнение, описывающее изменение энтропии системы с течением времени при её стремлении к состоянию термодинамического равновесия. Считать, что передача теплоты от одного тега к другому описывается формулой: 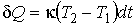 , где , где 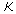 - коэффициент теплопередачи. - коэффициент теплопередачи.
Решение: После достижения системой состояния термодинамического равновесия температура тел станет одинаковой (см. задачу 3.6):
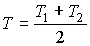 ,
а её энтропия примет максимальное значение 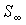 . .
Изменение энтропии системы при её переходе в равновесие можно определить по формуле (см. задачу 3.6):
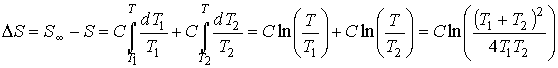 .
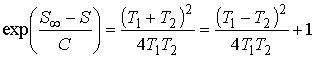 .
В соответствии со свойством аддитивности энтропии и формулой (3.52) для изменения энтропии системы можно записать:
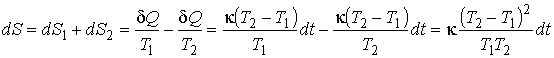 .
Здесь учтено, что теплота отводится от второго тела и подводится к первому.
Тогда уравнение, описывающее изменение энтропии с течением времени при стремлении системы к состоянию термодинамического равновесия, примет окончательный вид:
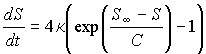 .
При 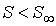 правая часть этого уравнения больше нуля, что соответствует росту энтропии с течением времени: правая часть этого уравнения больше нуля, что соответствует росту энтропии с течением времени: 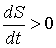 . При достижении энтропией системы . При достижении энтропией системы 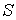 равновесного (максимального) значения равновесного (максимального) значения 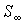 , правая часть полученного уравнения становится равной нулю, и дальнейшего роста энтропии не происходит. , правая часть полученного уравнения становится равной нулю, и дальнейшего роста энтропии не происходит.
|
 |
|
| |
 |
 |
| | |
|
 |
|
 |
 |
|
|